Každá spoločnosť musí pri žiadosti o povolenie na uvedenie na trh predložiť Európskej liekovej agentúre (EMA) plán riadenia rizík (RMP). RMP obsahuje informácie ako: bezpečnostný profil lieku; ako sa budú predchádzať alebo minimalizovať riziká u pacientov; plány na štúdie a iné aktivity na získanie ďalších vedomostí o bezpečnosti a účinnosti lieku; meranie účinnosti opatrení na minimalizáciu rizika. RMP sa priebežne upravujú a aktualizujú, vždy keď sú k dispozícii nové informácie. Spoločnosti musia predložiť aktualizovaný RMP na žiadosť EMA vždy, keď sa zmení systém riadenia rizík, najmä v dôsledku prijatia nových informácií, ktoré môžu viesť k významnej zmene profilu prínosu a rizika…
Zdroj EMA
Na stránke EMA je voľne dostupný RMP pre vakcínu Comirnaty (BioNTech a Pfizer) z februára 2022. Posledná aktualizácia je zo dňa 13/04/2022. Nižšie uvedieme pár informácií z dokumentu.
- Časť Kritériá pre vylúčenie z kľúčových klinický štúdií v rámci vývoja vakcíny(strana 88).
Ženy, ktoré sú tehotné alebo dojčia (strana 89).
Dôvod vylúčenia: Vyhnúť sa použitiu u zraniteľnej populácie.
Zdôvodnenie: Očkovanie matky vakcínou COVID 19 mRNA sa skúma v C4591015 s cieľom preskúmať neočakávané negatívne dôsledky pre embryo alebo plod (!!!).
- Bezpečnostný profil očkovacej látky nie je úplne známy u tehotných alebo dojčiacich žien z dôvodu ich počiatočného vylúčenia z hlavnej klinickej štúdie, avšak postmarketingové skúsenosti u tehotných žien sú dostupné. Dodatočne jedna klinická štúdia bezpečnosti a imunogenicity vakcíny COVID-19 u tehotných žien prebieha (C4591015)… (strana 105).
A teraz pár zaujímavostí z oficiálneho protokolu jedinej klinickej štúdie bezpečnosti Pfizer-u u tehotných žien C4591015 z ClinicalTrials.gov (zmeny pôvodného protokolu z 11/2/2021 ku dňu 22/8/2022).
1, Pôvodne plánovaný počet účastníčok štúdie bol 4000. Nakoniec bola štúdia ukončená len s 350. Prečo?
2, Pfizer mal poskytnúť prístup k anonymizovaným dátam a dokumentom ohľadom skúšania (napr. protokol, plán štatistickej analýzy, správu o klinickej štúdii) na požiadanie kvalifikovaných výskumníkov a za určitých kritérií, podmienok a výnimiek. Nakoniec sa rozhodol, že dáta neposkytne. Toto rozhodnutie prišlo až po roku klinického skúšania. Prečo?
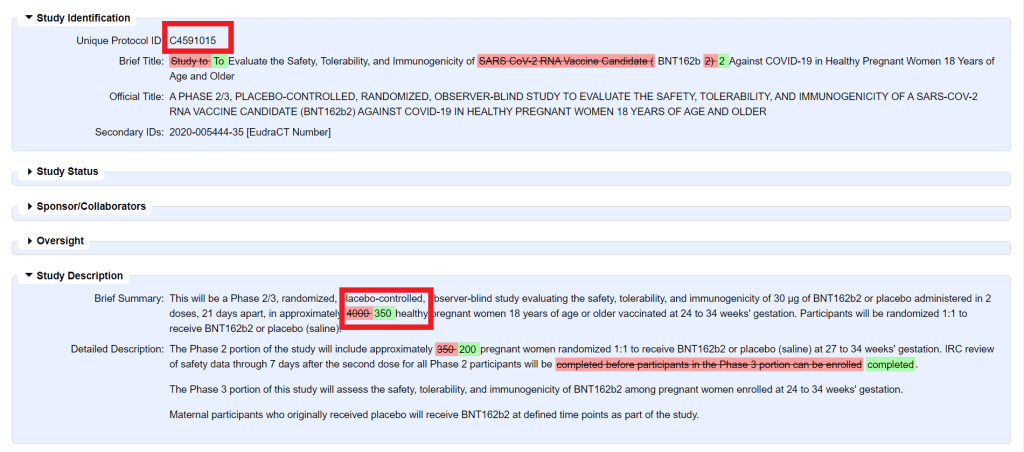

Celkovo 348 (209 vo fáze II a 139 vo fáze III) tehotných žien v 24. až 34. týždni tehotenstva bolo náhodne rozdelených do skupín v pomere 1:1 k vakcíne alebo placebu (RMP, strana 40).
Podľa amerického CDC (pozn. najobľúbenejšieho centra našich samozvaných odborníkov), by fáza II klinického skúšania mala zahŕňať niekoľko stoviek účastníkov. Fáza III klinického skúšania by mala zahŕňať 300 až 3000 účastníkov.
A čo na to Pfizer?
Zápis účastníkov do štúdie C4591015 bol zastavený 25. októbra 2021 z dôvodu náborových problémov v dôsledku globálnych odporúčaní pre očkovanie tehotných žien proti COVID-19 a zvýšenej dostupnosti vakcín proti COVID-19 (RMP, strana 40, poznámka 3 pod čiarou).
Chce nám teda Pfizer povedať, že ukončil nábor z dôvodu toho, že bolo „autoritami“ odporučené očkovanie tehotných žien? Ak áno, kto a na základe čoho v čase prebiehajúceho náboru a klinického testovania bezpečnosti a účinnosti vakcíny proti Covid-19 u tehotných žien povolil ich očkovanie? Odporučiť vakcínu tehotným ženám bez ukončenia klinického skúšania JEDINEJ štúdie bezpečnosti a účinnosti chce silný žalúdok. Ponúka sa teda otázka čo s „odborníkmi“, ktorí verejne odporúčali tehotným ženám na Slovensku očkovanie proti Covid-19 v čase keď bola bezpečnosť očkovacej látky predmetom klinického skúšania?
Publikácia zo dňa 21/4/2021 (update 8/9/2021)
Zber údajov prebiehal od 14/12/2020 – 28/2/2021.
Spomedzi 827 účastníčok, ktoré mali ukončené tehotenstvo, malo tehotenstvo za následok živé narodenie u 712 (86,1 %), spontánny potrat u 104 (12,6 %), mŕtve narodenie u 1 (0,1 %) a ďalšie (umelý potrat a mimomaternicové tehotenstvo) u 10 (1,2 %). Celkovo 96 zo 104 spontánnych potratov (92,3 %) sa vyskytlo pred 13. týždňom tehotenstva.
Nežiaduce výsledky medzi 724 živo narodenými dojčatami boli predčasný pôrod (60 zo 636 medzi očkovanými pred 37. týždňom [9,4 %]), malá veľkosť vzhľadom na gestačný vek (23 zo 724 [3,2 %]) a veľké vrodené anomálie (16 zo 724 [2,2 %]); v čase rozhovoru neboli hlásené žiadne úmrtia novorodencov.
VAERS prijal a spracoval 221 správ týkajúcich sa očkovania proti Covid-19 medzi tehotnými osobami; 155 (70,1 %) zahŕňalo nežiaduce udalosti špecifické pre tehotenstvo a 66 (29,9 %) zahŕňalo nežiaduce udalosti špecifické pre tehotenstvo alebo novorodenca. Najčastejšie hlásenými nežiaducimi udalosťami súvisiacimi s tehotenstvom boli spontánny potrat (46 prípadov; 37 v prvom trimestri, 2 v druhom trimestri a 7 prípadov, v ktorých bol trimester neznámy alebo nebol hlásený), nasledované narodením mŕtveho dieťaťa, predčasným pretrhnutím membrán, a vaginálne krvácanie s 3 hláseniami pre každú z nich.
Túto štúdiu si zapamätajte, čoskoro sa k nej vrátime…
#bezpečné? #dostatok štúdií? #bez vedľajších účinkov? #1 z 1000 000?