Čo je ACE2 receptor a akú funkciu zohráva v ľudskom tele?
ACE2 je receptor (proteín) na povrchu mnohých typov buniek. Je to enzým, ktorý generuje malé bielkoviny – štiepením väčšieho množstva bielkovín angiotenzinogénu, ktoré potom regulujú funkcie v bunke [1].
Angiotenzín II (ANG II) je proteín tvorený enzýmom konvertujúcim angiotenzín (ACE, alias/ ACE1). ANG II je vychytávaný receptorom ACE2, ktorý štiepi ANG II na menšie peptidy inhibujúce negatívny účinok ANG II.
Voľný (neviazaný) ANG II zvyšuje krvný tlak a zápal, a spôsobuje poškodenie výsteliek krvných ciev a rôzne typy poranení tkanív [1].
ACE2 je životne dôležitým proteínom v biochemickej ceste, ktorá je rozhodujúca pre reguláciu krvného tlaku, hojenia rán a zápalových procesov. Táto veľmi dobre popísaná dráha sa nazýva renín-angiotenzín-aldosterónový systém (RAAS) [1].
Ako súvisí ACE2 so SARS-CoV-2?
V dôsledku prítomnosti spike proteínu na svojom povrchu sa vírus SARS-CoV-2 viaže na ACE2 – ako kľúč vložený do zámku – pred vstupom a infikovaním buniek. ACE2 teda pôsobí ako bunková brána – receptor – pre vírus, ktorý spôsobuje COVID-19 (Obr. 1) [1].
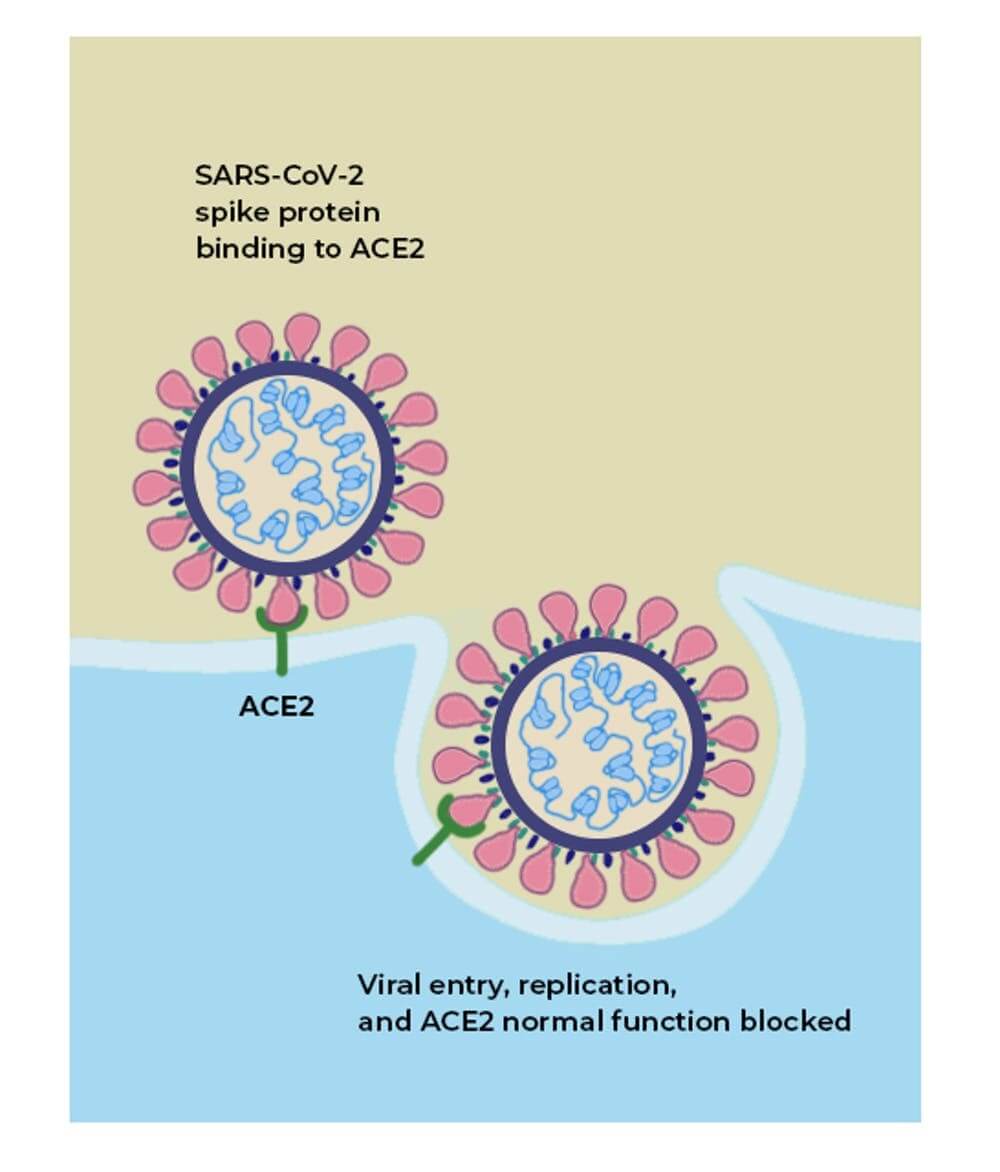
Obr. 1 ACE2 pôsobí ako receptor pre vírus SARS-CoV-2 a umožňuje mu infikovať bunku [1]. Keď sa vírus SARS-CoV-2 naviaže na ACE2, bráni mu vo vykonávaní svojej funkcie na reguláciu signalizácie ANG II. Účinok ACE2 je teda „inhibovaný“, čo vedie k zvýšeniu ANG II, s následkom väčšieho poškodenia tkanív, najmä pľúc a srdca u pacientov s COVID-19 [1].
Ak je množstvo dostupného ACE2 znížené tým, že vírus obsadzuje receptor, môžu byť jedinci náchylnejší na závažné ochorenie vyvolané SARS-Cov-2. Je to preto, lebo zvýšená prítomnosť ACE2 vedie k uľahčeniu vstupu vírusu do bunky, avšak pokles dostupného (voľného) ACE2 prispieva k väčšiemu poškodeniu sprostredkovanému ANG II (Obr. 2). Obzvlášť zníženie voľného ACE2 zvýši náchylnosť na zápal, bunkovú smrť (apoptózu) a zlyhanie orgánov, najmä srdca a pľúc [1].
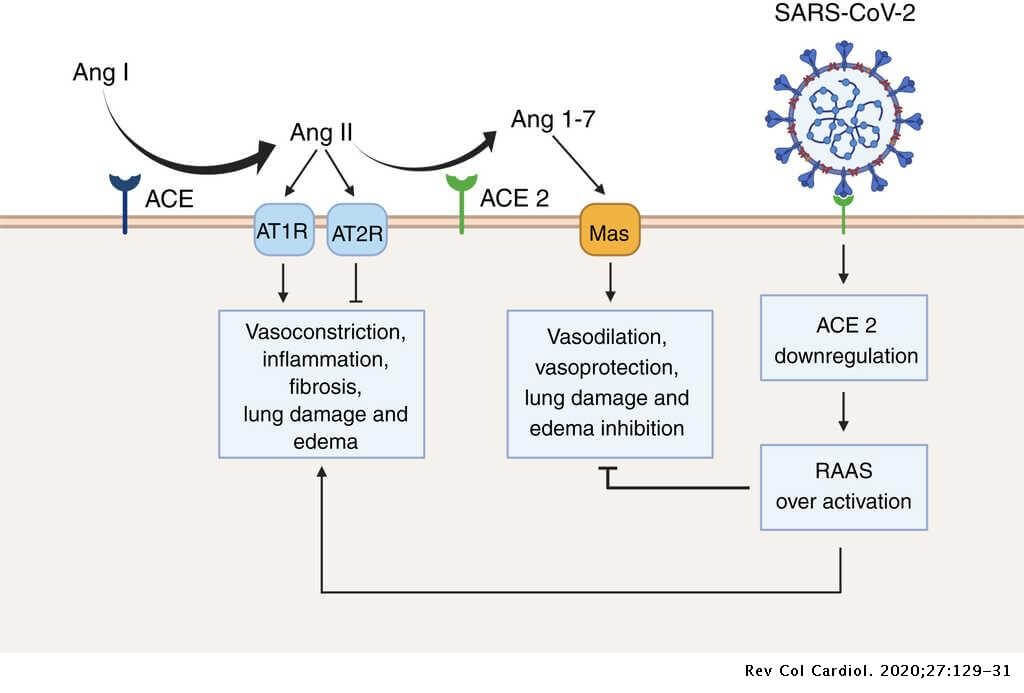
Obr. 2 Nadmerná aktivácia renín-angiotenzínového systému (RAAS) v dôsledku infekcie SARS-CoV-2. Za fyziologických podmienok metabolizuje angiotenzín konvertujúci enzým (ACE) angiotenzín I (Ang I) na angiotenzín II (Ang II), čo vedie k zvýšeniu vazokonstrikcie, zápalu, fibrózy, poškodenia pľúc a opuchov. Naopak, angiotenzín konvertujúci enzým 2 (ACE 2) inaktivuje Ang I generovaním angiotenzínu 1-7 (Ang 1-7), ktorý potom interaguje s receptorom spojeným s G-proteínom Mas. Je známe, že táto interakcia je vazoprotektívna, pretože antagonizuje účinky Ang I. SARS-CoV-2 však obsadzuje receptory ACE2, čo vedie k nadmernej aktivácii RAAS a k zvýšenému poškodeniu pľúc a opuchom [2].
Ako súvisí množstvo receptorov ACE2 s poškodením orgánových tkanív?
ACE2 je prítomný u všetkých ľudí, ale jeho množstvo v rôznych tkanivách a bunkách sa môže líšiť, rovnako tak aj medzi jednotlivcami. Niektoré dôkazy naznačujú, že množstvo ACE2 môže byť vyšie u pacientov s hypertenziou, cukrovkou a kardiovaskulárnymi ochoreniami [1].
Pľúca sú primárnym miestom poškodenia infekciou SARS-CoV-2, ktorá spôsobuje COVID-19. Ak dôjde k zníženiu aktivity ACE2 (pretože sa na ňu vírus viaže), potom ACE2 nemôže štiepiť proteín ANG II. Zvýšenie ANG II vedie k zvýšeniu zápalu a k poškodeniu pľúc [1].
Vírus ovplyvňuje aj ďalšie tkanivá, ktoré exprimujú ACE2, vrátane srdca, kde môže dôjsť k poškodeniu a zápalu (myokarditída). Taktiež môže dôjsť k poškodeniu obličiek, pečene a tráviaceho traktu. Miestom poškodenia môžu byť tiež krvné cievy [1].
ACE inhibítory a ARBs (angiotenín-receptor blokátory)
Enzým konvertujúci angiotenzín (ACE, alias ACE1) je ďalší proteín, ktorý sa nachádza v tkanivách, ako sú pľúca a srdce, kde je prítomný aj ACE2. Lieky, ktoré inhibujú pôsobenie ACE1, sa nazývajú ACE inhibítory. (Príklady týchto liekov sú ramipril, lisinopril a enalapril.) Tieto lieky blokujú účinky ACE1, ale nie ACE2. ACE1 riadi produkciu ANG II. ACE1 zvyšuje množstvo ANG II, zatiaľ čo ACE2 ho znižuje. (Obr. 3) [1].
Inhibítory ACE znižujú hladinu ANG II a tým potláčajú jeho účinky na zvyšovanie krvného tlaku a poškodenie tkanív. ACE inhibítory sa bežne predpisujú pacientom s hypertenziou, srdcovým zlyhaním a ochorením obličiek [1].
Ďalšia bežne predpisovaná skupina liekov, blokátory receptorov angiotenzínu (ARB) (ako napríklad Losartan, Valsartan atď.), majú podobné účinky ako ACE inhibítory a mohli by byť tiež užitočné pri liečbe COVID-19 [1].
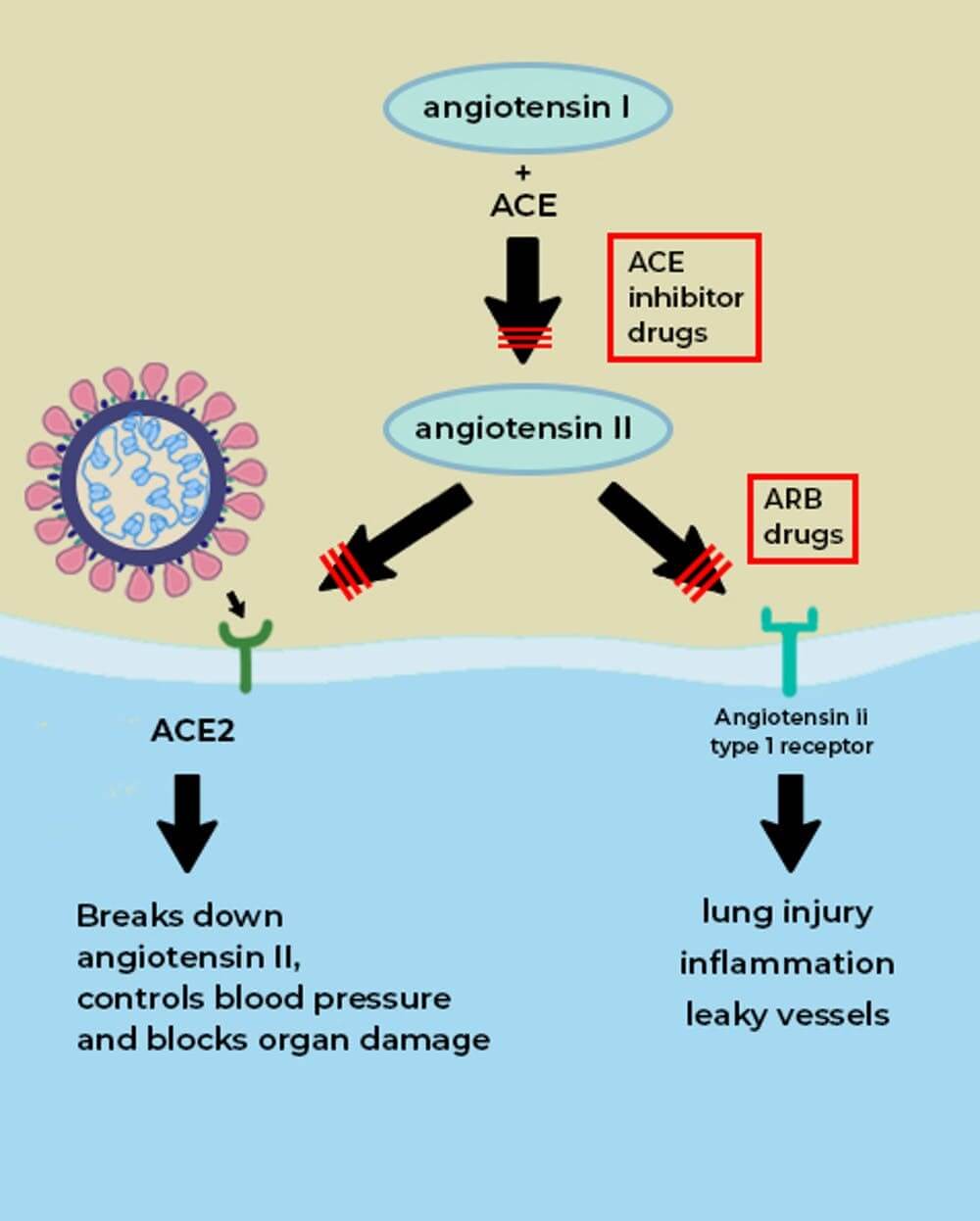
Obr. 3. Enzým ACE prevádza angiotenzín I na angiotenzín II. Hlavnou úlohou ACE2 je štiepenie angiotenzínu II na molekuly, ktoré pôsobia proti škodlivým účinkom angiotenzínu II; ale ak vírus obsadzuje „receptor“ ACE2 na povrchu buniek, potom je jeho úloha oslabená (červené čiary). Lieky nazývané ACE inhibítory inhibujú tvorbu angiotenzínu II, ktorý by inak interagoval s receptorom angiotenzínu typu 1 a spôsoboval poškodenie a zápal tkanív. Lieky nazývané ARB blokujú interakciu angiotenzínu II s jeho receptorom. (Obrázok prevzatý z NEJM) [1].
Reverzná transkriptáza koronavírusov
Nevyriešeným problémom choroby Covid-19 je, že pacienti často zostávajú pozitívni na vírusovú RNA (pozitívny PCR test) aj mnoho týždňov po počiatočnej infekcii. SARS-CoV-2 je vírus s pozitívnym vláknom RNA. Rovnako ako iné beta-koronavírusy (SARS-CoV-1 a koronavírus súvisiaci s respiračným syndrómom na Blízkom východe), aj SARS-CoV-2 využíva RNA-dependentnú RNA polymerázu na replikáciu svojej genómovej RNA a transkripciu subgenomických RNA [3-6].
Jedným z možných vysvetlení pokračujúcej detekcie vírusovej RNA SARS-CoV-2 bez reprodukcie vírusu je, že v niektorých prípadoch sa môžu kópie DNA vírusových subgenomických RNA integrovať do DNA hostiteľskej bunky mechanizmom reverznej transkripcie – polymeráza theta (mechanizmus popísaný v skoršom článku na blogu akw – https://akw.sk/covid-19/velky-problem-rna-sa-prepisuje-do-dna/ ). Takéto chimérické transkripty boli detegované v tkanivách získaných od pacienta. Prepis integrovaných kópií DNA by mohol byť zodpovedný za pozitívne testy PCR dlho po vyliečení počiatočnej infekcie [7].
Prečo je to problém?
V súčasnosti viaceré štúdie poukazujú na prítomnosť spike proteínu po očkovaní v rôznych orgánových štruktúrach ako je kostná dreň, srdce, pečeň, obličky, vaječníky u žien rovnako ako semenníky u mužov a iné [8]. Modelové štúdie na zvieratách s použitím zmesy lipidov totožnej s vakcínou Comirnaty a mRNA molekuly kódujúcej netoxický enzým luciferázu pri intramuskulárnom podaní, preukázali jej skorú distribúciu do krvného obehu, pričom veľmi vysoké hladiny rádioaktívnych lipidov sa hromadili v pečeni, slezine, nadobličkách aj vaječníkoch [9].
Dôkazy naznačujú, že pokiaľ mRNA obsiahnutá vo vakcíne kóduje spike protein, budú všetky tieto orgány vystavené jeho pôsobeniu. Kým exprimovaný spike protein z vakcíny obsadí ACE2 receptory zasiahnutých orgánov, hromadenie ANG II môže pôsobiť zápalovo a poškodzovať orgánové tkanivá. ANG II je navyše silný vazokonstriktor, teda spôsobuje hypertenziu, prispieva k rozvoju aterogenézy stimuláciou proliferácie buniek cievnej hladkej svaloviny, pričom dlhodobý efekt je pozorovateľný najmä v cievnej stene myokardu (hypertrofia a remodelácia cievnej steny myokardu) a ľadvín (hypertrofia glomerulov, proliferácia mezangia a konstrikcia vas afferens → zvyšuje reabsorbciu Na v proximálnom tubule). V konečnom dôsledku má dlhodobý vzostup koncentrácie ANG II silný pro-onkogénny vplyv – je stimulovaný rast hladkých svalových buniek ciev a priečne pruhovanej svaloviny srdca, zvyšuje sa syntéza kolagénu a tiež tvorba superoxidových radikálov [10].
Literatúra
[2] González-Rayas, J. M., Rayas-Gómez et al. (2020). COVID-19 and ACE-inhibitors and angiotensin receptor blockers-: The need to differentiate between early infection and acute lung injury. Revista Colombiana De Cardiologi´ a, 27(3), 129-131.
[3] V’kovski, P., Kratzel, A., Steiner, S., Stalder, H., & Thiel, V. (2021). Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology, 19(3), 155-170.
[4] Alanagreh, L., Alzoughool, F., & Atoum, M. The human coronavirus disease COVID-19: its origin, characteristics, and insights into potential drugs and its mechanisms. Pathogens 2020; 9 (5): 331.
[5] De Wit, E., Van Doremalen, N., Falzarano, D., & Munster, V. J. (2016). SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology, 14(8), 523-534.
[6] Fehr, A. R., & Perlman, S. (2015). Coronaviruses: an overview of their replication and pathogenesis. Coronaviruses, 1-23.
[7] https://www.pnas.org/content/118/21/e2105968118#ref-2
[8] Hansen, T., Titze, U., Kulamadayil-Heidenreich, N. S. A., Glombitza, S., Tebbe, J. J., Röcken, C., … & Wilkens, L. (2021). First case of postmortem study in a patient vaccinated against SARS-CoV-2. International Journal of Infectious Diseases, 107, 172-175.
[9] https://www.naturalnews.com/files/Pfizer-bio-distribution-confidential-document-translated-to-english.pdf
[10] Martínková, J., Mičuda, S., Cermanová, J. Vybrané kapitoly z klinické farmakologie pro bakalářské studium : Kardiovaskulární systém [online]. 2000. Dostupné na: https://www.lfhk.cuni.cz/farmakol/predn/bak/kapitoly/prednasky/kardio-bak.ppt/