NE(OČKOVANIE) DETÍ – 3. ČASŤ
Dňa 19.10.2022 EMA (Európska lieková agentúra) odporučila schválenie vakcín Comirnaty a Spikevax COVID-19 pre deti vo veku od 6 mesiacov.
Celkom nás prekvapilo, že o schválení týchto „vakcín“ informoval zatiaľ len ŠÚKL. Nové vedenie ŠÚKL-u si na roky 2022 – 2025 stanovilo strategické ciele. V oblasti komunikácie nás zaujalo najmä posilnenie dôvery v regulačné systémy a proaktívna komunikácia so všetkými zainteresovanými stranami.
Preto chceme veriť, že v zmysle naplnenia strategického plánu sa k rodičom dostanú VŠETKY informácie o očkovacích látkach, klinickom skúšaní a jeho výsledkoch.
Nižšie uvedieme v bodoch pár informácií a podnetov na zamyslenie, na ktoré sa môžete v prípade záujmu pýtať, a na ktoré Vám určite radi odpovedia MZ SR, MUDr. Elena Prokopová, ŠÚKL a možno aj osobnosti vakcinačnej kampane.
- Počet klinických štúdií, v ktorých bola vakcína Pfizer u detí vo veku 6 mesiacov až 4 roky testovaná: 1
- Stav: Aktívna
- Názov: Štúdia na vyhodnotenie bezpečnosti, znášanlivosti a imunogenicity kandidáta na RNA vakcínu proti COVID-19 u zdravých detí a mladých dospelých
- Fáza klinického skúšania: štúdia zlučuje všetky 3 fázy (I, II, III)
- Číslo štúdie: C4591007
- Dátum kedy bol prvý účastník zahrnutý do štúdie: 24.3.2021
- Predpokladané ukončenie štúdie: 24.5.2024
- Počet detí vo veku 6 mesiacov – 4 roky zahrnutých do klinického skúšania (fáza 2/3):
1 178 príjemcov BNT162b2 a 598 príjemcov placeba vo veku od 6 mesiacov do 23 mesiacov
1 835 príjemcov BNT162b2 a 915 príjemcov placeba vo veku 2 až 4 roky, ktorí dostali aspoň jednu dávku skúšaného produktu.
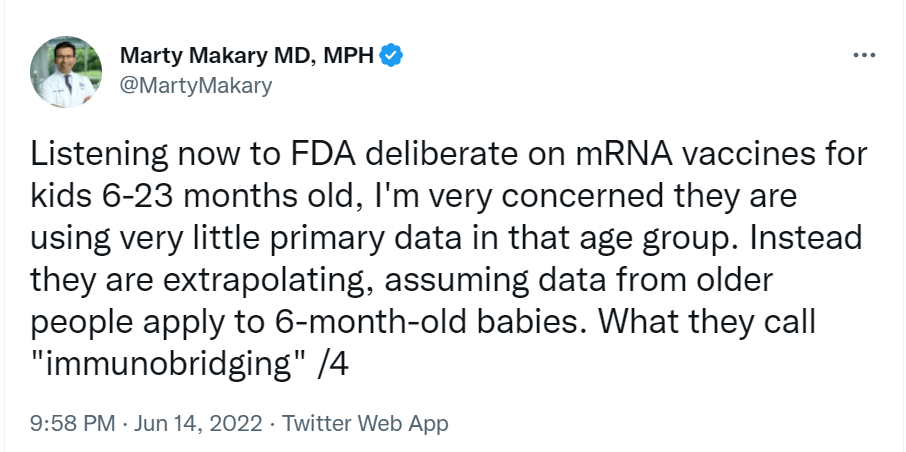
- Marty Makary, chirurg a výskumník na Univerzite Johnsa Hopkinsa, kritizoval prístup FDA k schvaľovaniu mRNA vakcín. Povedal: „Som veľmi znepokojený, že v tejto vekovej skupine (6-23 mesiacov) používajú veľmi málo primárnych údajov. Namiesto toho extrapolujú, za predpokladu, že údaje od starších ľudí platia aj pre 6-mesačné deti.“
V tejto súvislosti dávame do pozornosti jeden článok uverejnený v British Journal of Clinical Pharmacology, ktorý je síce staršieho dátumu, ale poslúži na pochopenie vyššie uvedeného (pozn. Google prekladač celkom obstojne pomôže). Uvedieme len pár kľúčových informácií:
Odporúčanie u detí je často založené na extrapolácii zo štúdií u dospelých kvôli nedostatku pediatrických údajov.
Deti nie sú „malí dospelí“. Ich prejav choroby môže mať odlišnú prirodzenú históriu od dospelých a môžu tiež trpieť chorobami, ktoré sa u dospelých nevyskytujú.
Deti majú fyziologické, vývojové, psychologické a farmakologické vlastnosti, ktoré sa líšia od dospelých a taktiež sa tiež líšia naprieč jednotlivým vekovými skupinami v rámci detského veku. Môžu metabolizovať určité lieky odlišne od dospelých, čo vedie k neočakávaným reakciám, nežiaducim vedľajším účinkom na lieky a toxicite…
Spoliehanie sa na údaje o bezpečnosti a účinnosti u dospelých pri odporúčaní lieku deťom, môže byť nepredvídateľné s fatálnymi následkami.
Celý článok je dostupný TU.
- Štyria republikánski kongresmani podporovaní 14-timi ďalšími napísali šéfovi FDA, Robertovi Califfovi sťažnosť, že CDC a FDA majú univerzálnu politiku, ako dostať vakcínu medzi ľudí „bez ohľadu na vek, rizikové faktory, zdravotný stav jednotlivca alebo predchádzajúcu infekciu“ a že mnohé otázky o vakcínach zostali nezodpovedané. Vyzvali FDA reagovať na 19 bodov, vrátane zverejnenia ďalších údajov, poskytnutia viac informácií o deťoch v klinických štúdiách a zodpovedania otázok o kardiovaskulárnych rizikách a účinnosti medzi najmladšími deťmi.
Celý text je dostupný TU.
Veríme, že pred schválením používania očkovacích látok na slovenských deťoch ŠÚKL starostlivo všetko overí a skontroluje…